KAIST 김호민·DGIST 고재원 교수 “뇌정신질환 치료제 활용될 것”
시냅스 발달 조절 복합체 구조.한국연구재단 제공
신경세포는 다른 신경세포와 연접하며 형성되는 시냅스를 통해 신호를 전달한다.
시냅스의 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스와 억제성 시냅스의 발달과 그 기능을 유지한다.
두 시냅스는 서로 균형을 맞춰 신경전달이 효율적으로 일어날 수 있게 하는데, 균형이 깨질 경우 자폐증, 조울증 등 다양한 뇌정신질환이 발생한다.
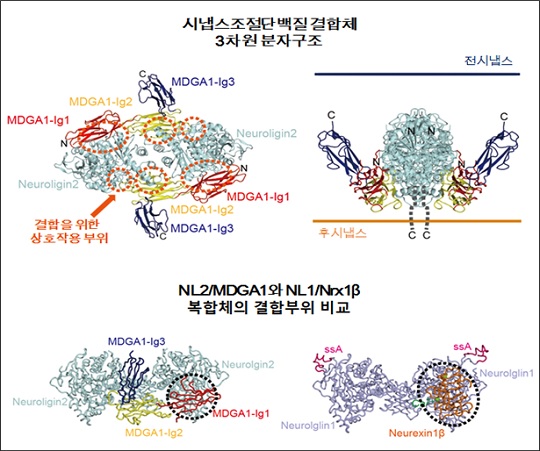
연구팀은 뉴롤리진과 뉴렉신의 결합을 조절하는 핵심단백질인 ‘MDGA1’의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 메커니즘을 최초로 규명했다.
연구팀은 억제성 시냅스에서 MDGA1과 뉴렉신은 경쟁적으로 뉴롤리진-2와 결합을 할 수 있으나, 뉴렉신보다 더 강한 결합 친화도를 가진 MDGA1이 우선적으로 뉴롤리진-2와 결합하여 뉴롤리진2/MDGA1 복합체를 만들어 뉴롤리진2/뉴렉신 결합을 방해함으로써 억제성 시냅스 발달을 조절하고 있음을 밝혔다.
이어 연구팀은 흥분성 시냅스와 억제성 시냅스의 대표적인 시냅스 접착단백질인 뉴롤리진-1과 뉴롤리진-2에 대한 MDGA1의 선택적 결합을 이해하기 위해 ‘생체외’와 ‘생체내’ 단백질 결합실험을 각각 수행했다.
그 결과 MDGA1이 억제성 시냅스에 존재하는 Neurolgin-2에만 선택적으로 결합하여 억제성 시냅스 발달에 선택적으로 작동함을 밝혀냈다.

(왼쪽부터) KAIST 김호민 교수·DGIST 고재원 교수.한국연구재단 제공
이를 통해 연구팀은 흥분성·억제성 시냅스 균형이상으로 발생하는 다양한 뇌정신질환의 발병 메커니즘을 이해하는데 필수적인 기초 신경과학 지식을 마련했다.
김호민 교수는 “이번 연구성과는 단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통하여 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명하였다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것”이라고 말했다.
이번 연구결과는 국제학술지 ‘뉴런(Neuron)’ 6월 21일자에 게재됐다.
ynwa21@ilyodsc.com